〒480-1195 愛知県長久手市岩作雁又1番地1
概要
当委員会は,臨床研究法第23条第4項の規定により認定を受けた臨床研究審査委員会です。(委員会の詳細はこちら(学外サイト)![]() )
)
| 委員会の名称 | 愛知医科大学病院臨床研究審査委員会 Certified Clinical Research Review Board of Aichi Medical University Hospital |
|---|---|
| 委員会の所在地 | 愛知県長久手市岩作雁又1番地1 |
| 認定番号 | CRB4180011 |
| 有効期間 | 2018年6月8日から2021年6月7日まで |
| 委員会の名称 | 愛知医科大学病院臨床研究審査委員会 Certified Clinical Research Review Board of Aichi Medical University Hospital |
|---|---|
| 委員会の所在地 | 愛知県長久手市岩作雁又1番地1 |
| 認定番号 | CRB4200004 |
| 有効期間 | 2021年2月1日から2024年1月31日まで,2024年2月1日から2027年1月31日まで |
委員会開催日程
【認定番号:CRB4180011】
原則として,毎月第1月曜日に開催します。(開催時間 午後3時から)
詳細は,愛知医科大学病院臨床研究審査委員会開催日程(2018年度)(PDF: 18 KB),愛知医科大学病院臨床研究審査委員会開催日程(2019年度)(PDF: 22 KB),愛知医科大学病院臨床研究審査委員会開催日程(2020年度)(PDF: 23 KB),愛知医科大学病院臨床研究審査委員会開催日程(2021年度)(PDF: 22 KB)でご確認ください。
※新規申請を行う場合は,委員会開催日の5週間前までに提出してください。
【認定番号:CRB4200004】
原則として,毎月第1月曜日に開催します。また,必要に応じて適宜開催します。(開催時間 午後3時から)
詳細は,愛知医科大学病院臨床研究審査委員会開催日程(2020年度)(PDF: 20 KB),愛知医科大学病院臨床研究審査委員会開催日程(2021年度)(PDF: 48 KB),愛知医科大学病院臨床研究審査委員会開催日程(2022年度)(PDF: 55 KB),愛知医科大学病院臨床研究審査委員会開催日程(2023年度)(PDF: 55 KB),愛知医科大学病院臨床研究審査委員会開催日程(2024年度),愛知医科大学病院臨床研究審査委員会開催日程(2025年度)でご確認ください。
※新規申請を行う場合は,委員会開催日の5週間前までに提出してください。
審査依頼から研究実施までの流れ
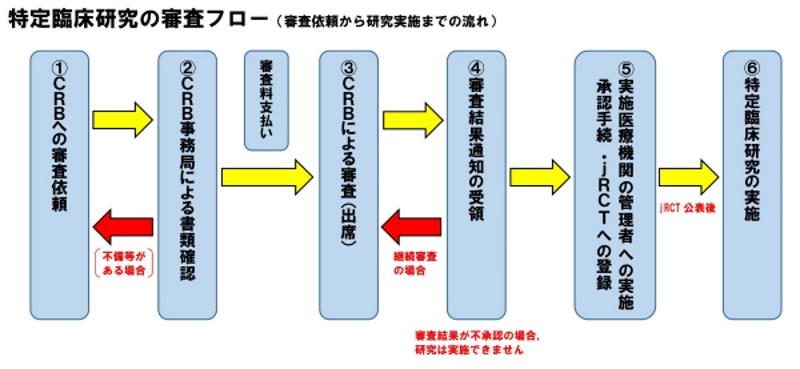
① CRBへの審査依頼
審査を依頼する場合は,以下の書類を臨床研究審査委員会開催日の5週間前までに提出してください。
○ 提出書類(データを電子メールにて送信してください。)
新規審査依頼書(統一書式2),実施計画(様式第一),研究計画書,説明文書・同意書(同意撤回書を含む),
研究分担医師リスト(統一書式1),利益相反関係資料(様式A,様式E),医薬品等の概要を記載した書類(ある場合),
その他CRBが求める書類
(研究計画書に記載がない場合)疾病等が発生した場合の対応に関する手順書,モニタリングに関する手順書
(作成した場合)監査に関する手順書,統計解析計画書
○ 提出先
愛知医科大学研究推進部研究支援課(E-Mail amu_crb@aichi-med-u.ac.jp)
〒480-1195 愛知県長久手市岩作雁又1番地1
※期日を超えて提出された場合は,翌月に開催される委員会で審査することがあります。
② CRB事務局による書類確認
書類の不足,記載内容の不備等があった場合は指定された期日までに修正してください。
※期日までに修正後の書類が提出されない場合は,翌月の委員会で審査することがあります。
③ CRBによる審査
CRBには,原則として研究責任(代表)医師が出席して研究の概要を説明いただき,委員からの質問にお答えいただきます。
審査料は,所定の期日までに指定された口座にお振り込みください。
※期日までに振込が確認できない場合は,翌月の委員会で審査することがあります。
④ 審査結果通知の受領
審査結果が「継続審査」の場合は,「承認以外の場合理由等」の内容を確認し,実施計画等を修正してください。修正後の書類はCRBで改めて審査します。
※審査結果が「不承認」の場合,当該研究を実施することはできません。
⑤ 実施医療機関の管理者への実施承認手続・jRCTへの登録
審査結果通知をもとに管理者の承認を受ける手続を行ってください。
※多施設共同研究の場合は,各施設の研究責任医師に審査結果通知を送付し,各研究責任医師が当該施設の管理者への実施許可手続を行ってください。
jRCTへの登録処理を行い,実施計画を担当地方厚生局へ届け出てください。
⑥ 特定臨床研究の実施
jRCTへの登録が完了し,一般公開された時点で当該特定臨床研究を実施することができます。
※jRCTで公開されるまでは研究を実施することができません。
審査手数料
委員会規程等
申請書類様式
1 審査に係る申請・報告・届出書類
※特定臨床研究を実施しようとする場合は,「特定臨床研究の開始時手続きに関するチェックリスト」に従って手続してください。
(1) 新規申請
- 実施計画(様式第一) ※>実施計画の提出方法
jRCTで実施計画を入力する場合の作成例(PDF: 3988KB)
jRCT操作マニュアル
実施計画作成モデル
注)jRCTで実施計画を入力し「一時保存」を行った後に「様式1」ボタンで出力したものを提出してください。 - 研究分担医師リスト(統一書式1)
- 新規審査依頼書(統一書式2)
- 研究計画書[任意様式]
- 説明文書(補償の概要を含む。),同意文書[任意様式]
- 疾病等が発生した場合の対応に関する手順書[任意様式]
- モニタリングに関する手順書[任意様式]
- 利益相反関係様式(Excel: 615KB) [利益相反管理基準(様式A),利益相反管理計画(様式E)]
注)利益相反関係書式は,当委員会での審査前に産学連携室へ提出し,利益相反委員会による審査を受ける必要があります。 - 監査に関する手順書[任意様式] 【ある場合】
- 統計解析計画書[任意様式] 【ある場合】
- 医薬品等の概要を記載した書類 【ある場合】
【他機関を主たる研究機関とする多施設共同研究において病院長の実施承認を得たい場合】
- 臨床研究実施許可願書 [院内専用様式]
※主たる研究機関で審査された書類に本様式を添えて提出してください。
(2) 研究実施中
- 変更審査依頼書(統一書式3)
※変更前に(研究の進捗に係る変更については変更後に遅滞なく)提出してください。 - 定期報告書(統一書式5)
※臨床研究審査委員会で研究の継続について審査を受けた後に,厚生労働大臣へ報告してください。
(実施計画を厚生労働大臣に提出した日から起算して1年ごとに,当該期間満了後2か月以内に提出してください。) - 重大な不適合報告書(統一書式7)
- 医薬品疾病等報告書(統一書式8)
- 医療機器疾病等又は不具合報告書(統一書式9)
- 再生医療等製品疾病等又は不具合報告書(統一書式10)
- 詳細記載用書式(統一書式8~10共通)
(3) 研究終了・中止時
2 書類提出先
研究推進部研究支援課(大学本館4階) 担当:岡,吉田,谷口
3 申請書類提出時の注意
- 申請に係る添付資料を印刷する際には,資料の種類ごとに両面印刷してください。
臨床研究審査委員会議事概要
【2018年度(CRB4180011)】
第1回(2018年7月2日) (PDF: 59 KB)
第2回(2018年8月6日) (PDF: 68 KB)
第3回(2018年9月3日) (PDF: 59 KB)
第4回(2018年10月1日) (PDF: 67 KB)
第5回(2018年11月5日) (PDF: 67 KB)
第6回(2018年12月3日) (PDF: 76 KB)
第7回(2019年1月7日) (PDF: 56 KB)
第9回(2019年2月4日) (PDF: 119 KB)
第12回(2019年3月4日) (PDF: 97 KB)
【2019年度(CRB4180011)】
第1回(2019年4月1日) (PDF: 80 KB)
第2回(2019年5月13日) (PDF: 68 KB)
第3回(2019年6月3日) (PDF: 59 KB)
第4回(2019年7月1日) (PDF: 97 KB)
第5回(2019年8月5日) (PDF: 75 KB)
第6回(2019年9月2日) (PDF: 86 KB)
第7回(2019年11月11日) (PDF: 68 KB)
第8回(2019年12月2日) (PDF: 86 KB)
第9回(2020年1月6日) (PDF: 86 KB)
第10回(2020年2月3日) (PDF: 86 KB)
第11回(2020年3月2日) (PDF: 86 KB)
【2020年度(CRB4180011)】
第1回(2020年4月6日) (PDF: 94 KB)
第2回(2020年5月11日) (PDF: 75 KB)
第3回(2020年6月1日) (PDF: 82 KB)
第4回(2020年7月6日) (PDF: 76 KB)
第5回(2020年8月3日) (PDF: 65 KB)
第6回(2020年9月7日) (PDF: 76 KB)
第7回(2020年10月5日) (PDF: 69 KB)
第8回(2020年11月2日) (PDF: 87 KB)
第9回(2020年12月7日) (PDF: 64 KB)
第10回(2021年1月4日) (PDF: 65 KB)
第11回(2021年2月1日) (PDF: 71 KB)
第12回(2021年3月1日) (PDF: 79 KB)
【2021年度(CRB4180011)】
第1回(2021年5月10日) (PDF: 94 KB)
第2回(2021年6月7日) (PDF: 74 KB)
【2020年度(CRB4200004)】
第1回(2021年3月1日) (PDF: 62 KB)
【2021年度(CRB4200004)】
第1回(2021年7月5日) (PDF: 68 KB)
第2回(2021年7月19日) (PDF: 66 KB)
第3回(2021年8月2日) (PDF: 65 KB)
第4回(2021年8月23日) (PDF: 66 KB)
第5回(2021年9月6日) (PDF: 66 KB)
第6回(2021年10月4日) (PDF: 63 KB)
第7回(2021年10月18日) (PDF: 67 KB)
第8回(2021年11月1日) (PDF: 68 KB)
第9回(2021年11月22日) (PDF: 65 KB)
第10回(2021年12月6日) (PDF: 66 KB)
第11回(2021年12月20日) (PDF: 68 KB)
第12回(2022年2月7日) (PDF: 133 KB)
第13回(2022年3月7日) (PDF: 231 KB)
【2022年度(CRB4200004)】
第1回(2022年4月18日) (PDF: 147 KB)
第2回(2022年5月16日) (PDF: 219 KB)
第3回(2022年6月6日) (PDF: 214 KB)
第4回(2022年7月4日) (PDF: 224 KB)
第5回(2022年8月1日) (PDF: 219 KB)
第6回(2022年9月5日) (PDF: 195 KB)
第7回(2022年10月3日) (PDF: 199 KB)
第8回(2022年10月24日) (PDF: 220 KB)
第9回(2022年11月7日) (PDF: 200 KB)
第10回(2022年11月21日) (PDF: 225 KB)
第11回(2022年12月5日) (PDF: 199 KB)
第12回(2023年1月16日) (PDF: 69 KB)
第13回(2023年3月6日) (PDF: 114 KB)
【2023年度(CRB4200004)】
第1回(2023年4月3日) (PDF: 269 KB)
第2回(2023年5月1日) (PDF: 176 KB)
第3回(2023年6月5日) (PDF; 155 KB)
第4回(2023年8月7日) (PDF; 145 KB)
第5回(2023年9月4日) (PDF; 179 KB)
第6回(2023年10月2日) (PDF; 128KB)
第7回(2023年11月6日) ,(PDF; 201KB)
第8回(2023年12月4日) (PDF; 243KB)
第9回(2024年2月5日) (PDF; 243KB)
第10回(2024年3月4日) (PDF; 243KB)
【2024年度(CRB4200004)】
第1回(2024年4月22日) (PDF; 243KB)
第2回(2024年5月13日) (PDF; 243KB)
第3回(2024年6月3日) (PDF; 243KB)
第4回(2024年7月1日) (PDF; 243KB)
第5回(2024年8月5日) (PDF; 243KB)
第6回(2024年9月2日) (PDF; 243KB)
第7回(2024年10月7日) (PDF; 243KB)
第8回(2024年12月2日) (PDF; 243KB)
第9回(2025年1月6日) (PDF; 243KB)
【2025年度(CRB4200004)】
関連リンク
- 臨床研究法について(厚生労働省)
 (学外サイト)
(学外サイト) - 臨床研究等提出・公開システム(jRCT)
 (学外サイト)
(学外サイト)
お問い合わせ先
愛知医科大学 研究推進部研究支援課
〒480-1195 愛知県長久手市岩作雁又1番地1
TEL 0561-62-3311(内線23827,23828)
E-Mail amu_crb@aichi-med-u.ac.jp














