-
〒480-1195 愛知県長久手市岩作雁又1番地1
TEL : 0561-62-3311
構内全面禁煙 

中央臨床検査部の中山享之教授(特任)・部長が再生医療のFirst in human試験の実施を承認されました
2018.12.21
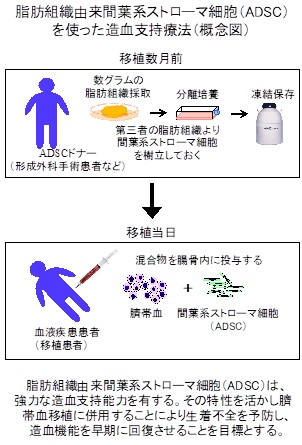
研究のイメージ
中央臨床検査部の中山享之教授(特任)・部長が計画している「脂肪組織由来間葉系幹細胞を使用した臍帯血移植時における新規生着促進療法の安全性に関する臨床研究」が,平成30年9月21日付けで厚生科学審議会再生医療等評価部会による審査を経て実施承認が得られました。
この研究は,他家(他人)の脂肪組織由来間葉系ストローマ細胞(ADSC)を使用するため再生医療等安全性確保法における第一種再生医療等に区分されます。そのため再生医療等の提供計画を厚生労働大臣に提出することが義務化されています。また,本学独自のシーズであり,基礎研究から臨床応用へのトランスレーショナルリサーチです。また,First in human(ヒトに応用するのは世界で初めて)となります。
造血幹細胞移植の一つである臍帯血移植においては,ドナー負担がない,既に冷凍保存されているため迅速に活用できる,移植合併症の危険性が低いなどの利点があり,施行件数が近年増加しています。しかし,生着不全や生着遅延が他の移植法に比べて多く,感染の増加や輸血依存期間の延長が発生しており,これらはコストがかさむだけではなく,患者の精神的肉体的苦痛を増し,しいては生存率を下げる要因ともなります。そのため造血幹細胞数が少ない臍帯血は,生着不全や生着遅延が更に増す恐れから,利用されず貴重な細胞資源が無駄となっていました。つまり,これらの欠点を克服することは,世界的に喫緊の課題となっていました。
中山先生からは「間葉系ストローマ細胞は,もともと骨髄内にあり造血をサポートしています。ですが,微量しか含まれておらず採取には侵襲を伴うので,樹立培養して臨床に応用するのは実際的ではありません。そこで,間葉系ストローマ細胞を多量に含むとされる脂肪組織に注目して研究を進めましたが,予想外のことにADSCが骨髄由来のものの代替となるだけではなく,優れた造血支持能力を有することが判明しました(特許出願済)。ADSCを臍帯血移植に併用すれば,造血組織の再生を促し生着不全と生着遅延を克服できると予想されます。脂肪組織は,美容整形などで採取・廃棄されており細胞資源としても豊富でドナー負担もありません。ADSCは,増殖が速いため,臨床に必要な量を調達するのも容易です。免疫抑制作用等の細胞活性も高く臍帯血移植の合併症を抑制する作用も見込まれます。大動物を用いたADSC投与試験においても有害事象は認められず,ヒトに投与しても安全性が担保できると判断されたため,この臨床試験を計画しました。安全性を確認する第I相試験から開始し,有効性を確認する第III相試験までの施行を予定していますが,気を引き締めて施行したいと考えています。」との感想がありました。
用語説明
間葉系ストローマ細胞
中胚葉性組織(間葉)に由来する体性幹細胞。脂肪細胞や軟骨細胞への分化能をもつため再生医療への応用が期待されている。その他に,免疫抑制作用や造血支持能力を有する。採取する組織により特性が異なる。
 お問合せ
お問合せ