| 疾患・病態を制御する生理活性物質の探索と分子デザイン |
分子標的医薬探索寄附講座 梅澤一夫
 私達は致死的臓器炎症や癌を抑制する低分子化合物の探索および作用機構の解明、さらに発見した化合物を用いて疾患の機構解析を行っている。生理活性物質は主に細菌、放線菌、カビなど微生物、および植物から探索している。さらに、見出した化合物の構造をかえる分子デザイン・合成も行っている。
私達は致死的臓器炎症や癌を抑制する低分子化合物の探索および作用機構の解明、さらに発見した化合物を用いて疾患の機構解析を行っている。生理活性物質は主に細菌、放線菌、カビなど微生物、および植物から探索している。さらに、見出した化合物の構造をかえる分子デザイン・合成も行っている。
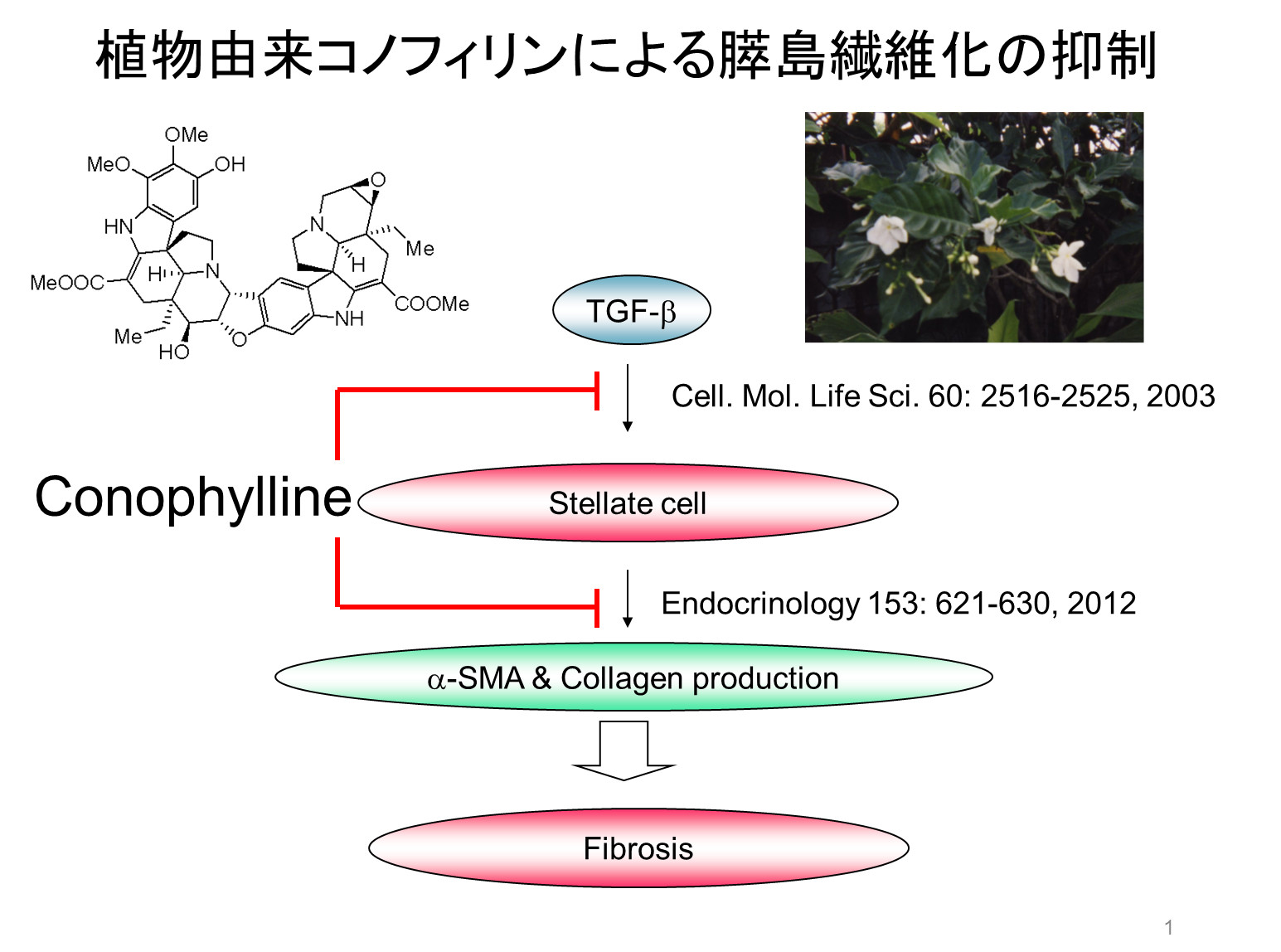
最近、代表的な致死的臓器障害のひとつである繊維化の阻害剤を見出した。すなわち植物から得られるconophyllineは2型糖尿病モデルラットにおいて経口投与により膵島繊維化を抑制した。抑制の機構として以前にTGF-beta signalの抑制を報告したが、さらに繊維化原因細胞stellate cellの減少や活性阻害を示した。
一方、私たちの見出したNF-kappa B阻害剤DHMEQの主な機構はDNA結合阻害であるが、新しい阻害の機構としてRelBに共有結合することで、その不安定化およびimportin alpha-5との親和性を低下させることを見出した。開発基礎研究としては、光学活性(-)-DHMEQ調製のため、リパーゼ反応に使える基質を効率よ く合成できるようにした。DHMEQは炎症性腸疾患の動物モデルにおいて病態を軽減させた(7)。臓器移植における拒絶反応はやはり臓器障害によるが、 DHMEQをdonor specific blood transfusionと併用することで強い抑制効果がみられるようになった。新しい疾患モデルの抑制として、気道のアレルギー性炎症を抑えることを報告 した。さらにDHMEQは鼻腔ポリープfibroblastにおける炎症性サイトカインの分泌を下げることがわかった。抗癌活性としては、転移浸潤の機構 として、乳癌細胞の接着にNF-kappa B/galectin3 binding protein が関与していることを示唆した(3)。またDHMEQを用いて乳癌幹細胞のシグナルにNF-kappa Bが関与していることがわかった(4)。DHMEQはin vivoでglioblastomaモデルを抑制し、前立腺癌のradiation sensitivityを上げた。一方、in vivo抗炎症活性のあるDTCM-GはNF-kappa Bを阻害することがわかった。さらに、2型糖尿病治療剤に広く使われるグリベンクラミドはKチャネル阻害剤として働き、癌細胞浸潤を阻害することを見出し た。またミミズの産生するペプチドlyseninによるヒツジ赤血球溶血阻害物質を天然から探索したところ、植物から既知物質all-E-luteinが単離された。
既知物質の新しい利用法の開拓も行っている。微生物から癌細胞の遊走・浸潤阻害物質として微生物から既知化合物paxillineが得られた。paxillineは比較的、毒性が強いが、活性としてK-channel阻害が知られている。そこでやはりK-channelを阻害する、毒性のないglybenclamideに注目した。glybenclamideは2型糖尿病治療に経口薬として広く使われている。この化合物はマトリゲル・チャンバーで卵巣癌細胞の浸潤を阻害した。機構にPDGF-Aの分泌阻害が関与していることもわかった。
以上のように、植物由来低分子化合物のconophylllineが致死的臓器障害のひとつ繊維化を抑制することを見出したが、詳細な作用機構はまだわかっていない。一方、NF-kappa B 阻害剤DHMEQは阻害機構がさらに進展し、動物実験において多くの抗炎症・抗癌活性を示して毒性がない。致死的臓器障害の改善に利用できる可能性がある。


