
| エネルギー代謝を標的とする新たな白血病治療法の開発に向けた基盤研究 |
血液内科 三輪啓志
 私達は白血病細胞のエネルギー代謝に関し研究を行っています。正常細胞においては主にミトコンドリアのクエン酸回路で酸素を利用してエネルギーを産生していますが、がん細胞においては主に酸素を必要としない解糖によりエネルギーを得ているとされています。私達はこれまでの検討で解糖系優位にエネルギー産生を行う白血病細胞株(NB4)とTCAサイクルでの酸化的リン酸化(特に脂肪酸を利用)優位な白血病細胞株(THP-1)があることを報告してきました(Suganuma et al. Leukemia & Lymphoma 51: 2112-9, 2010)。
私達は白血病細胞のエネルギー代謝に関し研究を行っています。正常細胞においては主にミトコンドリアのクエン酸回路で酸素を利用してエネルギーを産生していますが、がん細胞においては主に酸素を必要としない解糖によりエネルギーを得ているとされています。私達はこれまでの検討で解糖系優位にエネルギー産生を行う白血病細胞株(NB4)とTCAサイクルでの酸化的リン酸化(特に脂肪酸を利用)優位な白血病細胞株(THP-1)があることを報告してきました(Suganuma et al. Leukemia & Lymphoma 51: 2112-9, 2010)。
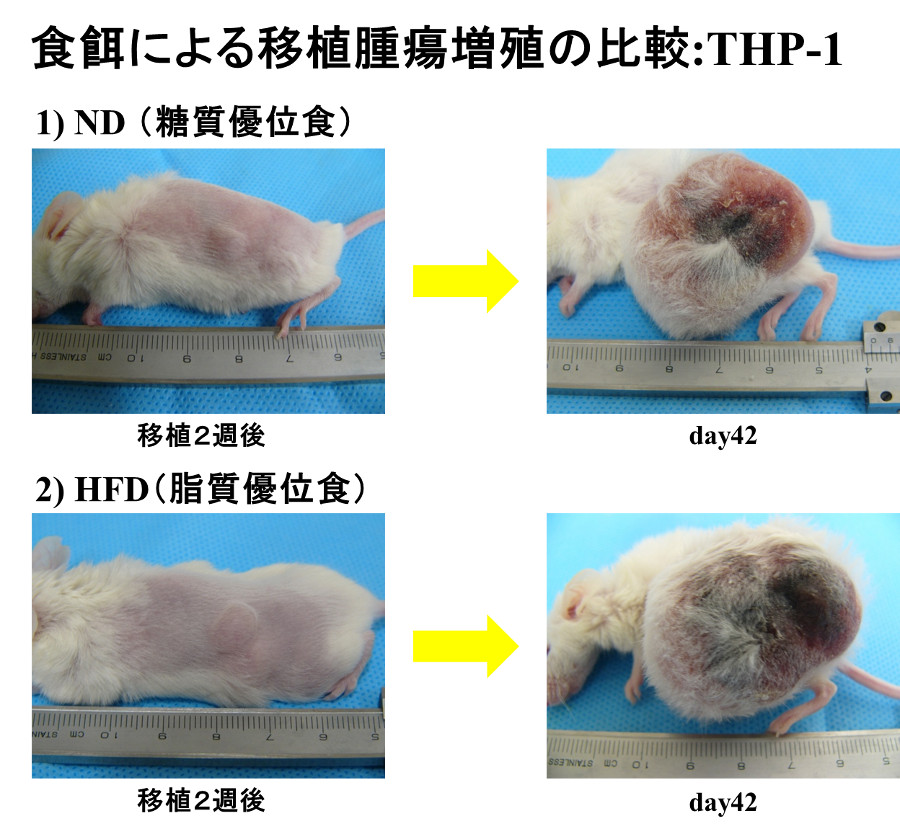
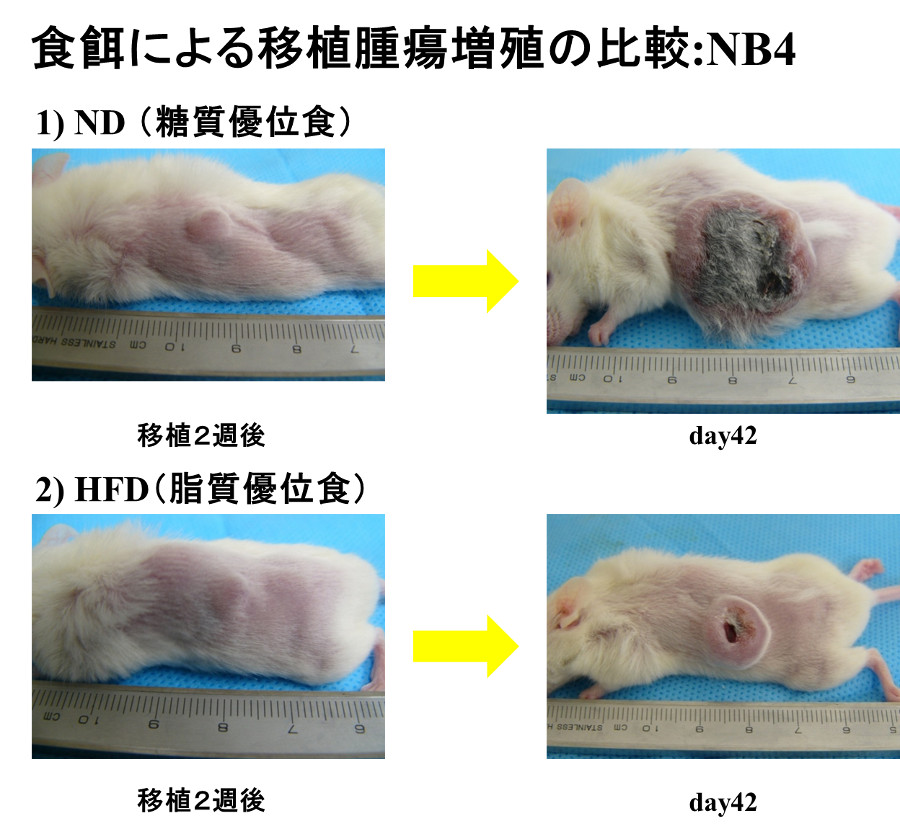
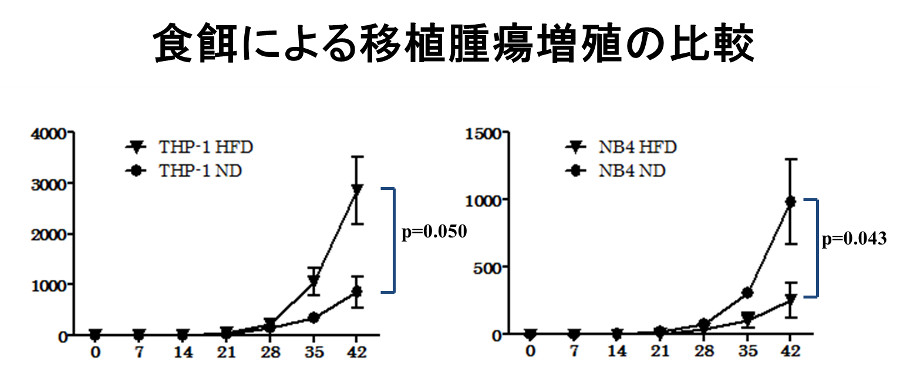
免疫不全マウスの皮下にそれぞれの白血病細胞株を移植し、糖質主体の食事、脂質主体の食事を与える群に分け腫瘤の大きさを経時的に測定すると、NB4の腫瘤は糖質主体の食事群の方がより大きくなりました。一方、THP-1の腫瘤は脂質主体の食事群の方がより大きくなりました。また、脂肪酸の酸化を阻害するetomoxirを投与するとTHP-1の腫瘤は著明に縮小しました。解糖系を阻害する2-deoxyglucoseを投与すると両細胞株ともに著明に縮小しました。2-deoxyglucoseを投与した腫瘤を組織学的に検討するとNB4では広範な壊死が認められましたが、THP-1では壊死巣は大きくありませんでした。エネルギー代謝関連分子の免疫染色をすると、THP-1ではphospho-AMPK, phospho-ACC, CPT1Aの発現亢進が認められました。以上より、THP-1では2-deoxyglucoseを投与するとエネルギーセンサーであるAMPKが活性化しACC(acetyl-CoA carboxylase:脂肪酸合成の律速酵素)をリン酸化(不活化)、そしてCPT1Aにより脂肪酸をミトコンドリア内に運搬し、β酸化によりエネルギーを産生すると考えられました。解糖系がブロックされることによるエネルギー不足は、脂肪酸酸化によりある程度補われ、増殖のスピードは遅くなるが壊死巣はそれほど大きくならないと考えられました。一方、NB4は主なエネルギー産生経路である解糖系を阻害されるとTHP-1のような代償機構が働かず、エネルギー不足により大きな壊死巣が生ずると考えられました。
白血病細胞でもエネルギー産生機構は、解糖系優位のもの、ミトコンドリアでの酸化的リン酸化優位のもの(THP-1では脂肪酸酸化が重要と考えられますが、グルタミンが重要と考えられる白血病細胞もあります)と多様性があることが明らかとなってきました。次世代の白血病治療として、エネルギー代謝を標的とする治療法を開発するにあたり、個別に主要エネルギー産生機構を明らかにすることは重要と考えます。
主要研究者・三輪啓志先生は2014年4月に退職されました。本研究は退職までの内容です。


